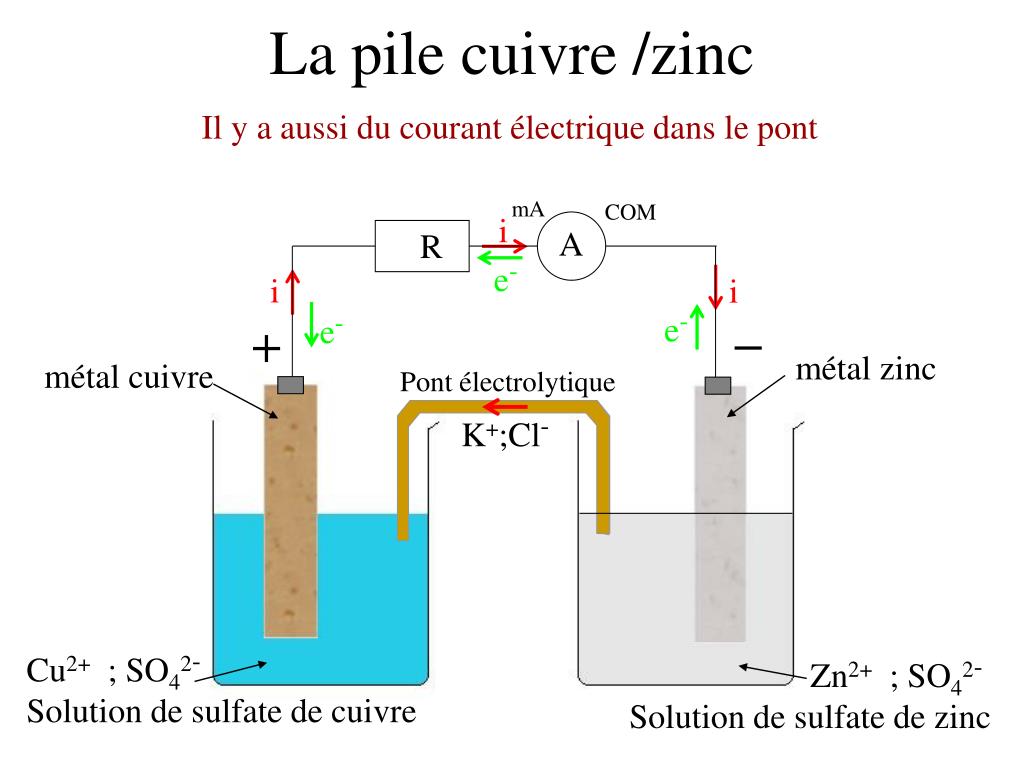
A) dessiner sur votre copie, le schéma du circuit.
Depot electrolytique de cuivre. On distingue 2 types de cuivrage : Un courant électrique amène les ions de cuivre des anodes à pénétrer dans la solution et à se déposer sur la cathode. Il devient un revêtement attirant.
La préparation est différente selon la matière de base. Principe de l’electrolyse a anode soluble !lorsqu’on relie une électrode conductrice (la « cathode ») à la borne négative d’un générateur de tension continue, on observe la formation d’un dépôt solide à sa surface. Bain argent technique 650 l.
Nickel protection du cuivre précédemment déposé par une couche de nickel. Les impuretés tombent et forment des boues ou restent en solution. Les épaisseurs vont du micron au millimètre voire parfois plus.
On peut cuivrer tout substrat que ce soit fer, aluminium, zamak ou autres. Dépôt de cuivre, brillant ayant pour but de restituer la brillance à la pièce et d'apporter les caractéristiques électrochimiques propres à ce métal. Découpage de la matière première les différents prototypes sont tracés sur les plaques du laiton, en tenant compte de leurs caractéristiques.
Ensuite ces plaques sont découpées soit manuellement ou électriquement. Les dépôts électrolytiques de cuivre peuvent être utilisés dans la décoration. De l'or aurait pu être déposé en poudre ou à la feuille sur des statues en bois et une immersion dans une solution de cuivre simultanément à un contact avec du zinc aurait pu permettre le dépôt.
Le dépôt de cuivre électrolytique est un procédé mis en oeuvre dans des bains électrolytiques dans lesquels l'objet de cuivre agit en tant que cathode, tandis que l'anode est réalisée à partir de cathodes de cuivre pur. Le cuivre est un métal peu oxydable qui présente plusieurs degrés d’oxydation possibles. De la vis micrométrique au tonneau jusqu’à 1500 mm à l’attache.


















