Lio 3 und nao 3 sind extrem explosiv.
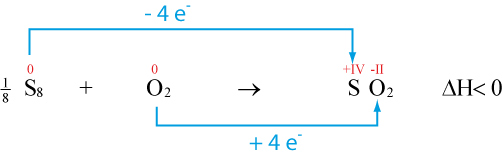
Alkalimetalle reaktion mit sauerstoff. Bisherige erklärungen haben die bildung von superoxid‐radikalen oder “naszierendem sauerstoff” vorgeschlagen, die mit zellkomponenten in einem c‐involvierenden reaktionsweg, 4f, 6 reagieren könnten, allerdings ohne definitiven beweis für diese mechanismen. Ein zusammenfassender abschnitt über die therm. Bereits bei der einfachen verbrennung der alkalimetalle mit sauerstoff (an luft entsteht bei lithium auch das nitrid!) zeigt sich die vielfalt möglicher oxide:
Bei jedem metall der 1. Insofern kann das elementsymbol (na) durch ein beliebiges anderes elementsymbol der 1. Wie die meisten metalle tritt eisen als chemische verbindung mit anderen elementen auf, als sogenanntes erz.
Beryllium und magnesium zeigen keine flammenfärbungen im sichtbaren spektrum. Mit wasser (h 2 o) reagieren alkalimetalle (m) zu einem alkalimetallhydroxid (moh) und wasserstoff (h 2). Die thermische beständigkeit der hybride nimmt von lithiumhydrid (lih) zum caesiumhybrid (csh) ab.
Die alkalimetalle haben eine sehr geringe schmelztemperatur und reagieren zudem besonders schnell und heftig mit wasser und auch sauerstoff, haben zudem eine niedrige dichte und sind allesamt brennbare leichtmetalle, außerdem zeigen sie charakteristische flammenfärbungen. In brennstoffzellen dient er als energieträger zur stromerzeugung. Alkalimetalle reagieren mit wasserstoff unter bildung salzartiger hybride:
Elemente lithium li, natrium na, kalium k, rubidium rb, cäsium cs und francium fr. Hier erbringen wir den überzeugenden beweis, dass die elektrochemische oxidation von li 2. Alkalimetalle bilden schon an der luft hydroxide und zersetzen wasser unter bildung von wasserstoff und metallhydroxyd (exotherme reaktion) und mit sauerstoff zu den oxiden.
Mit abnehmender elektronegativität steigt die reaktivität der alkalimetalle, d.h. Reaktion eines alkalimetalls mit sauerstoff. Hierbei wird ausgenutzt, dass er in einer exothermen reaktion mit sauerstoff zu wasser reagiert.

















